近期,國家衛(wèi)健委在官網(wǎng)更新《關于印發(fā)涉及人的生命科學和醫(yī)學研究倫理審查辦法的通知》之后,神州醫(yī)療就兩版?zhèn)惱韺彶檗k法的區(qū)別之處做了全文的梳理以及內(nèi)容的解讀。今天,我們將從醫(yī)療大數(shù)據(jù)場景之下的數(shù)據(jù)及隱私安全問題出發(fā),就在真實世界研究當中如何進行知情同意和倫理審查的角度進一步進行探討。
一、使用醫(yī)療大數(shù)據(jù)進行研究時,存在的數(shù)據(jù)隱私安全隱患
一般來說,醫(yī)療大數(shù)據(jù)在真正投入到產(chǎn)生真實世界證據(jù)之前,需要經(jīng)歷數(shù)據(jù)挖掘、數(shù)據(jù)收集、數(shù)據(jù)存儲、數(shù)據(jù)治理、數(shù)據(jù)分析等步驟,最終在應用層產(chǎn)生相應的數(shù)據(jù)。
隨著健康醫(yī)療數(shù)據(jù)的爆發(fā)式增長,醫(yī)療數(shù)據(jù)的安全形勢也十分嚴峻。首先在數(shù)據(jù)存儲過程中,可能會面臨數(shù)據(jù)的惡意篡改及泄露相關風險。其次,在研究過程中,往往會涉及患者相關醫(yī)療數(shù)據(jù)的采集和使用,在大數(shù)據(jù)場景下,數(shù)據(jù)采集的形式主要包括主動采集和被動采集兩種。在這兩種形式中,都需要確保被研究對象的知情同意和隱私保護。在實際醫(yī)療大數(shù)據(jù)相關的研究中,由于存在諸多不確定性,導致如何合理有效地獲得患者的知情同意并非易事,這也是大數(shù)據(jù)研究快速發(fā)展背景下亟待解決的問題。
二、新《辦法》后,真實世界研究過程中的知情同意及倫理審查探討
2.1 真實世界研究過程中的知情同意
真實世界研究可應用于整個藥品生命周期管理中。在藥物研發(fā)階段,通過RWS可發(fā)現(xiàn)新的藥物靶點;在臨床試驗階段,可通過RWS了解疾病負擔和未被滿足的需求,也可了解到已有的療法和產(chǎn)品的信息,也可發(fā)現(xiàn)潛在受試者。在藥品上市/發(fā)展階段,通過RWS了解藥品的風險及效益,開展藥品的安全性及有效性監(jiān)測。藥品上市后,可通過RWS來探索新的適應證,對藥品生命周期進行管理,推進疾病負擔研究,藥物經(jīng)濟學研究,有助于推進藥品進醫(yī)保。
在醫(yī)學研究和藥物、醫(yī)療器械研發(fā)工作中,真實世界研究節(jié)約經(jīng)濟成本,一定程度上更加符合倫理學原則。但也存在一定的隱患和問題,通常存在于知情同意、數(shù)據(jù)質(zhì)量、數(shù)據(jù)管理和隱私保護、利益沖突管理、證據(jù)收集和應用、安全性及風險與受益等方面。
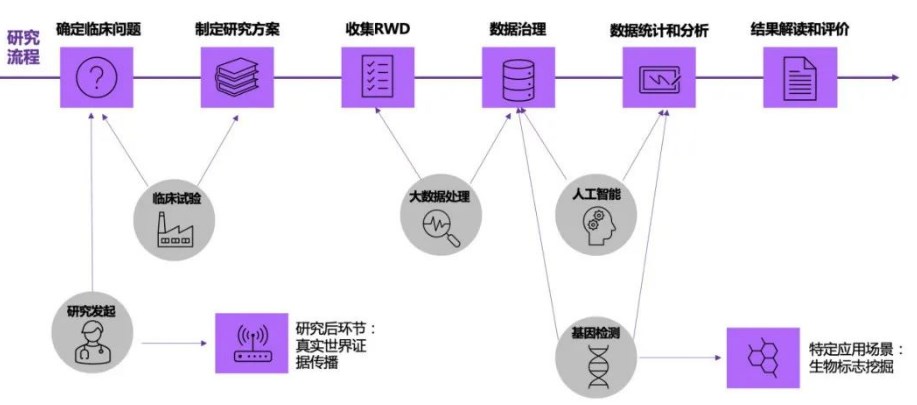
圖:真實世界研究實施流程
真實世界研究中可能涉及大量患者信息,相關的患者在特定情形下則會成為該等研究的“受試者”。《赫爾辛基宣言》規(guī)定,“對于使用可識別的人類材料或數(shù)據(jù)的醫(yī)學研究,如對生物庫或類似存儲庫中的材料或數(shù)據(jù)的研究,醫(yī)生必須對其收集、存儲和/或再使用征得知情同意”。因此,通常而言,在真實世界研究中使用真實世界數(shù)據(jù)應當取得相關患者的知情同意。
知情同意(informed consent)是包括真實世界研究在內(nèi)的所有涉及人的健康相關研究當中,最基本、最重要的倫理要求之一。恰當、充分的知情同意是落實受試者權益保護的關鍵環(huán)節(jié)。
傳統(tǒng)意義上的知情同意主要存在于醫(yī)生-患者、研究者-受試者之間,通過書面知情同意的方式,授權相對明確。在真實世界研究中,研究目的明確的真實世界研究的知情同意與傳統(tǒng)臨床研究中知情同意所采取的方式基本相同。但是,由于很多真實世界研究是利用臨床診療電子病歷信息或剩余生物樣本,研究方案在數(shù)據(jù)或生物樣本采集之初尚未擬定,研究目的尚不明確,尤其是對于一些需要通過數(shù)據(jù)挖掘以發(fā)現(xiàn)臨床診療規(guī)律或總結臨床經(jīng)驗的研究,要求獲得每位受試者同意,將其臨床醫(yī)療數(shù)據(jù)用于未來研究,具有非常大的挑戰(zhàn)。
此外,研究者的傾向性、信息不對稱、壓力影響等,都可能導致知情同意難以落實。因此,傳統(tǒng)臨床研究中通常采用的特定知情同意在真實世界研究中應用有限,在真實世界研究的知情同意階段可根據(jù)實際情況考慮泛知情同意、動態(tài)知情同意、“泛知情+動態(tài)知情同意”或免除簽署知情同意書。
泛知情同意和動態(tài)知情概念、特點及適用范圍:
泛知情同意是知情同意的一種特殊形式,是指健康數(shù)據(jù)或生物樣本在將來研究的范圍內(nèi)受制于告知內(nèi)容和/或過程的非特定知情同意。在以下三種情況中,是使用泛知情同意的最佳狀態(tài):其一是可以大致地劃分研究范圍,并告知數(shù)據(jù)提供者,其數(shù)據(jù)可能會被哪些研究人員以及研究機構使用;其二是數(shù)據(jù)的收集者和儲存者能夠?qū)ξ磥戆l(fā)生的相關研究進行批準和監(jiān)管,在管理層面具有嚴格的治理體系,確保研究的科學性和有效性;其三是無法確保可持續(xù)地與數(shù)據(jù)提供者保持聯(lián)系,并定期與提供者交流研究的進展。
相較于泛知情同意,動態(tài)知情同意首先需要更活躍、更有潛力、能夠參與更多互動交流過程的醫(yī)療大數(shù)據(jù)貢獻者。動態(tài)知情同意強調(diào)“同意”不僅僅是溝通,更是一種數(shù)據(jù)提供者和研究者之間雙向的、持續(xù)的互動過程,這將有利于最大限度地提高數(shù)據(jù)利用的透明度,改善研究者和參與者的交流,達成對數(shù)據(jù)價值挖掘的最大共識。動態(tài)知情也并不像特定知情那樣有固定的形式,而是可以根據(jù)研究目的和內(nèi)容去建立相應的同意方式,例如生物銀行研究的參與者可以通過動態(tài)知情的平臺向研究項目提供知情同意,此后依舊可以通過平臺就新的研究活動向數(shù)據(jù)使用者表示是否給出新的同意。
動態(tài)知情同意可以提升參與者決策能力和參與度,可以讓參與者根據(jù)研究者告知的實質(zhì)信息,按照自己的真實價值觀理性做出決策,在一定程度上保護了參與者權利;但同樣存在的問題是,一旦參與者失去聯(lián)系,已經(jīng)采集并儲存的大數(shù)據(jù)信息會因無法獲取知情同意導致后續(xù)研究無法開展。
2.2 真實世界研究如何進行合理的受試者知情同意
真實世界研究以臨床研究信息共享系統(tǒng)為基礎,通過傳統(tǒng)的知情同意方式讓每個受試者充分知情同意,這在實踐上面臨諸多難題,因此可以采用不同要求、不同層次的方式以更好地落實知情同意。
美國受試者保護辦公室與FDA等機構于2016年聯(lián)合發(fā)布了《電子知情同意使用問答指南》,明確了電子知情同意相關流程與各方職責等關鍵性問題。電子知情同意作為一種高效、便捷的形式,在新型冠狀病毒肺炎疫情防控期間得到了廣泛應用。
前文提到,在真實世界研究的知情同意階段也可根據(jù)實際情況考慮泛知情同意、動態(tài)知情同意、“泛知情+動態(tài)知情同意”或免除簽署知情同意書。泛知情同意為保障受試者知情權與自主性提供了一種新思路。動態(tài)知情同意是讓受試者參與到使用其個人數(shù)據(jù)過程中的一種新方法。在初次知情同意后,受試者的數(shù)據(jù)以后每次被用于新研究之前,都要再次獲得知情同意,且受試者有權隨時退出研究。動態(tài)知情同意讓信息披露與知情同意處于開放、持續(xù)、動態(tài)變化的過程中,可以彌補泛知情同意中受試者不能隨時退出研究和研究過程不透明的弊端,且不會改變泛知情同意的高效優(yōu)勢。“動態(tài)+泛知情同意”不僅可以強化受試者的中心地位,讓其對個人信息掌握更多的主動權,維護了患者作為受試者的權益,還使研究過程更加公開,風險管理得以改善。
不同類型真實世界研究的知情同意側重有所不同。回顧性或利用剩余生物樣本的真實世界研究在申請免除簽署知情同意書時,倫理委員會應審查免除簽署知情同意書的合理性,遵守研究具有重要社會價值的原則,且研究風險不超過最低風險,免除簽署知情同意書不會威脅到受試者及其群體的健康和權益。對于前瞻性真實世界研究的數(shù)據(jù)采集和實施,知情同意的內(nèi)容應側重于闡明真實世界數(shù)據(jù)的用途、受試者隱私保護、數(shù)據(jù)安全相關技術以及管理等措施。
2.3 新《辦法》的倫理審查探討
新版?zhèn)惱韺彶椤掇k法》對知情同意書相關的應有內(nèi)容獲取與再次獲取條件進行了進一步細化和完善,但未提及11號令中對特定條件下免知情同意的相關內(nèi)容。因此,醫(yī)療機構如何制定自己的免除知情同意的標準亟待明確。出于減少科研人員不必要負擔的考慮,《辦法》第三十二條提出對于符合標準的研究可以免除倫理審查。免除的范疇包括針對不傷害、不涉及敏感個人信息和商業(yè)利益的、利用公開或匿名化信息以及合法來源樣本的研究,但同時必須滿足不得涉及人胚胎和生殖性克隆、嵌合、可遺傳的基因操作等具有高倫理風險的研究行為。由此可見,醫(yī)療機構針對全新概念的理解學習與制定標準操作流程,并且及時對研究者進行充分培訓迫在眉睫。
2.4 新《辦法》和11號令并行,規(guī)范知情同意的簽署
目前11號令并未失效,現(xiàn)階段將處于《辦法》和11號令并行狀態(tài),對于醫(yī)療機構來說“免除倫理審查”和“免除知情同意書簽署”的兩個環(huán)節(jié)的差異尤為明顯。知情同意是保護受試者權益的重要措施,《個人信息保護法》也明確提出只有在具有特定的目的和充分的必要性、并且采取嚴格保護措施的前提下,個人信息處理者方可處理敏感個人信息。本次《辦法》對于免除知情同意書簽署標準雖然未有提及,醫(yī)療機構仍可延續(xù)審查制度的一致性,繼續(xù)遵循11號令的兩條免除簽署的標準。
三、神州醫(yī)療可提供高質(zhì)量、藥品全生命周期的真實世界研究解決方案
神州醫(yī)療真實世界研究團隊可為藥企客戶提供整個藥品生命周期上的真實世界研究服務,研究類型涵蓋回顧性研究及前瞻性研究。
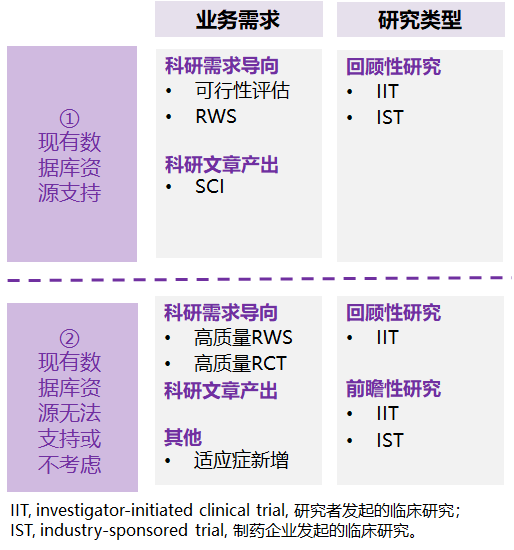
圖:神州醫(yī)療真實世界研究服務
首先,神州醫(yī)療在真實世界研究過程中,有豐富的受試者的數(shù)據(jù)收集、知情同意相關工作經(jīng)驗,可根據(jù)項目的具體需求,基于智能化數(shù)據(jù)采集系統(tǒng),靈活調(diào)整數(shù)據(jù)收集方式,以滿足客戶對真實世界研究數(shù)據(jù)質(zhì)量和執(zhí)行效率的需求。
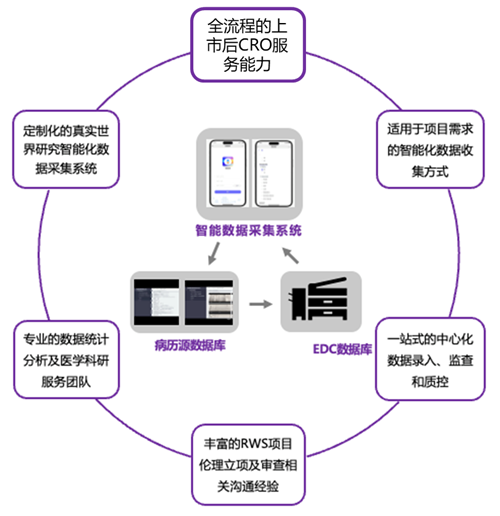
圖:神州醫(yī)療智能數(shù)據(jù)采集流程及優(yōu)勢
其次,神州醫(yī)療在立項和倫理審查相關工作中積累了大量經(jīng)驗,與眾多研究機構也建立了良好的溝通基礎。在新版《辦法》發(fā)布后,神州醫(yī)療將會積極與各機構進行溝通,并總結各個機構倫理審查相關的工作進展,攜手客戶和機構積極探索更適用于研究的數(shù)據(jù)收集及知情同意方式,共同推進我國真實世界研究的發(fā)展。
神州醫(yī)療RWS服務
神州醫(yī)療真實世界研究(RWS)團隊可為藥企提供專業(yè)化、智能化、高效率的真實世界研究項目服務。
神州醫(yī)療RWS業(yè)務具備完善的臨床執(zhí)行方案、靈活多變的臨床運營服務以及豐富的項目管理經(jīng)驗,可加快研究中心啟動速度。智能化數(shù)據(jù)采集系統(tǒng)、OCR+中心化人工錄入以及智能化數(shù)據(jù)質(zhì)量等技術可滿足多樣化的項目需求,快速提升臨床運營的效率并節(jié)約運營成本,大幅度提高RWS效率和質(zhì)量。
神州醫(yī)療配備專業(yè)的RWS服務團隊,從醫(yī)學服務、臨床運營、項目實施到技術支持,相關人員知識儲備和項目經(jīng)驗豐富,可支持大型RWS項目。
截至目前,神州醫(yī)療已為數(shù)十家內(nèi)資及MNC藥企提供基于藥品全生命周期的上市后臨床RWS服務,研究方向涵蓋藥品安全性監(jiān)測和療效評估、疾病負擔研究、藥物經(jīng)濟學研究及適應癥拓展等,項目經(jīng)驗豐富。
如您對神州醫(yī)療RWS服務感興趣,歡迎隨時與我們聯(lián)系。
公司網(wǎng)址:www.youngbeautiful.cn
總部地址:北京市海淀區(qū)北四環(huán)西路66號中國技術交易大廈19層
聯(lián)系電話:010-82689008